- ホーム
- 総合研究所
- 総合研究所 概要
- 事業年報
- 平成29年度 事業年報
- 7)イルカの健康管理に関する調査研究

海洋生物の調査研究
7)イルカの健康管理に関する調査研究
植田啓一*1・柳澤牧央*1
1.はじめに
現在、野生からの導入が困難になっているイルカの疾病に関して、的確な診断および治療が実施可能となるよう、診断技術や治療等の健康管理技術の維持と開発に取り組んでいる。特にイルカの主な感染症である細菌および真菌感染症等の起因菌特定のために必要となる遺伝子検査を積極的に行い、診断や治療に役立てている。また外科的処置や画像診断検査時に必要な麻酔技術の向上、展示動物の理学療法に基づいたQOL(Quality of Life)の改善について調査研究を行い、そこから得られた成果を活用し飼育動物の健康管理技術を開発することで野生生物の保全に貢献し、持続的なイルカ飼育に繋げるべく調査研究を展開している。
2.鯨類の麻酔
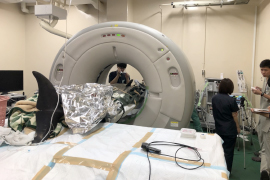
写真-1 宮崎大学でのバンドウイルカ全身麻酔下CT検査
鯨類のような100kg超える大型動物に対する全身麻酔は、専用の機器が必要であり、個体の重量が自身の肺に及ぼす悪影響が大きいため麻酔を専門とする獣医師が対応する必要がある。またその成否は、個体の生死の問題に直結するため、総合研究センターでは、麻酔の専門医を有する宮崎大学と共同研究を締結し、バンドウイルカの全身麻酔を実施すると同時に、麻酔時の生理的値等変動について調査研究を行っている。今年度は、全身麻酔を用いたCT撮影を平成29年11月29日に1頭、平成30年1月11-12日に2頭を実施した。全ての実施例で、導入は、ミダゾラム0.05mg/kgを筋肉内投与後、プロポフォールを静脈内投与し、気管挿管した後、セボフルランで維持した。計測した生理値は、終末呼気二酸化炭素分圧(ETCO2)、ヘモグロビン酸素飽和度(SpO2)血圧であった。結果、ETCO2は60mmHg以下、SpO2は85%以上、平均血圧は95-150mmHgであった。いずれの症例も、覚醒は良好であった。これまでの麻酔では、ETCO2が、70mmHgを超えることが繰り返し生じたため、安全に麻酔を継続することが不可能であったが、今回、麻酔機器の管理において、事前にバルブと弁の直前チェック、野外の低温(5度以下)で実施するときに生じる麻酔剤の気化問題に対して、酸素瓶を常温(20度程度)に維持する対策等を講じた。それにより好成績な結果を得ることとなった。特にETCO2が正常範囲(35-60mmHg)で調整可能になると全身麻酔が長時間可能になる、覚醒時間が短くなる等、麻酔を安全に実施するためには、非常に有効であった。水族館のような環境では、野外のストランディング等の不測の状況もあるため、常に、設備が整った場所(理想的な手術室)で実施できるわけではないため、必要な場所で実施するためには、温度等、環境の異なる場所に備えた対策を講じる必要がある。
3.CT検査を用いた骨学的構造の把握
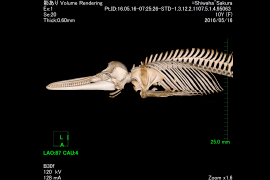
図-1 シワハイルカの肩甲骨の位置
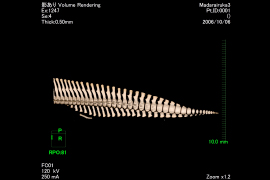
図-2 マダライルカの腰骨の位置
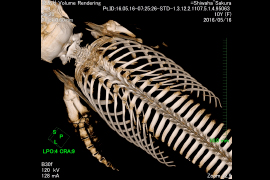
図-3 シワハイルカの肋骨の位置
鯨類の骨格標本として展示されている多くのものにおいては、いくつかの部位の骨が誤った位置に配置されているものも少なくない。それらは骨と骨とが直接関節しない部分があり位置決めの手がかりが無いからである。
今回は、1.肩甲骨、2.骨盤骨、3.肋骨に着目し、バンドウイルカ、ミナミバンドウイルカ、マダライルカ、シワハイルカ、マイルカの全身CT画像を解析し、各骨格の正確な位置を確認した。
1.肩甲骨の前端は頭蓋骨の直後、環椎の位置にある。(上腕骨との)関節窩は腹側を向き背側縁は頚椎・胸椎の横突起先端より腹側にある。2.1対の骨盤骨は側方に凸の状態で体軸とほぼ並行で、先端は第1尾椎〜第4尾椎の間に位置する。3.肋骨の前方にある4〜5対は、2頭肋骨では、肋骨頭は胸骨の椎体の肋骨窩と結合組織を介して関節しているが、骨と骨との間には数ミリあるいはそれ以上の隙間がある。肋骨結節は胸椎の横突起に関節する。後方にある肋骨は肋骨頭を失っており、単頭の状態で横突起と関節している。肋骨結節と胸椎の横突起の関節は、前方部分では骨と骨の隙間は短いが、後方に行くにつれ両者の隙間が大きくなり、最後部にある肋骨は胸椎と関節せずに“遊離肋骨”となる場合がある事が確認された。今後鯨種による相違を確認するためにも、データを増やして更なる解析を続けていく必要があると考える。
4.保護個体の血液培養から得られたVibrio furnissii
2017年4月17日嘉手納マリーナビーチにて、コッマコウを保護した。保護した日から4月23日の死亡する日まで、治療を継続的実施した。4月20日に実施した血液培養検査で陽性となったため、同定検査を実施した結果、Vibrio furnissiiと同定された。本菌は、人で下痢症を起こすことが報告されている。イルカへのVibrio属菌の感染例としては、Vibrio alginolyticusが知られているがVibrio furnissiiは未報告である。本菌はVibrio alginolyticusと違い、水槽内で採取されたことはない。そのため、今回のコマッコウは、野外で本菌に感染していたことが強く疑われた。
5.新興真菌感染症調査
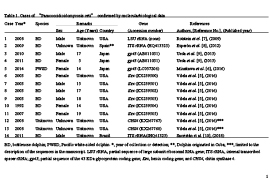
表-1 Paracoccidioidomycosis cetiの報告例

写真-2バンドウイルカのTrichosporon症例
クジラ型パラコクシジオイデス症,英名“paracoccidioidomycosis ceti”は、従来ロボミコーシス(Lobomycosis)、もしくはラカジオーシス(Lacaziosis)と呼ばれ、ヒトとイルカを宿主とする慢性難治性皮膚病であった。現在では、イルカ症例においては、分子生物学的にParacoccidioides spp.の遺伝子が検出された場合のみクジラ型パラコクシジオイデス症とすると定義している(表1)。一方、分子生物学的データがなく、臨床症状に加えて細胞診、病理検査、血清学的検査で診断された症例は、クジラ型パラコクシジオイデス症が疑われる症例とされ、目視や写真判定だけの旧来ロボミコーシス様疾患(lobomycosis-like disease)と言われていた症例も同様に扱われている。
我々は、他館飼育のカマイルカ症例を調査したところ、中南米の風土病パラコクシジオイデス症の原因菌Paracoccidioides brasiliensisに99.9%照合することを報告した。なお、カマイルカでのクジラ型パラコクシジオイデス症は世界初の症例に相当した事により、既知のイルカ種にとらわれず、精査することが重要である事が判明した。
またクジラ型パラコクシジオイデス症との鑑別を要する症例として、バンドウイルカに発症したTrichosporon症の報告を行った。この症例は臨床症状,細胞診および分離菌の形態がP. brasiliensisに酷似していたことからクジラ型パラコクシジオイデス症が強く疑われたが、分離菌はT. asteroidesであった。これにより病理検査や細胞診でロボミコーシスとして確定診断された症例にはTrichosporon属菌種によるものも含まれている可能性が示唆された結果となった。現在、分子生物学的確定診断には至らなかったが、クジラ型パラコクシジオイデス症が疑われるカマイルカ症例を調査中である。
*1動物研究室
Copyright (c) 2015 Okinawa Churashima Foundation. All right reserved.