メニュー
- ホーム
- 総合研究所
- 総合研究所 概要
- 事業年報
- 平成27年度 事業年報
- 8)パインアップルの大量増殖技術開発に関する調査

亜熱帯性植物の調査研究
8)パインアップルの大量増殖技術開発に関する調査
阿部篤志*1・仲宗根忠樹*2
1. パインアップル‘沖農P17’の大量増殖に伴う培地条件の検討
1)緒言
パインアップルの増殖は一般的に母茎から発生した冠芽や吸芽を挿す方法や、母茎を輪切りにする方法によって行われている。しかし、こうした従来より行われている方法は増殖率が悪く、新品種を早期に普及する場合や大量の苗が必要となる場合に対応できないのが課題である。
無菌条件下で植物の生長点を培養し、シュート増殖を図るメリクロン技術は、短期間に大量の苗を生産することができる技術として多くの栄養繁殖性植物で成果を上げている。パインアップルについても過去にメリクロン技術による効率的な増殖に成功した事例が複数報告されている。当財団における‘ゴールドバレル’等のパインアップル営利品種を用いた増殖調査に於いても、サイトカイニンの一種である6-ベンジルアミノプリン(以下、BA)を1mg/L添加した1/2濃度のムラシゲ・スクーグ培地(以下、1/2MS)にて生長点を無菌培養することで、効率的な増殖を示すことが明らかとなっている。
しかし、品種によってはこの培地組成でも十分増殖しないものが存在する。2013年の当財団における調査では、‘ゴールドバレル’‘ジュリオスター’の2品種において液体培養により増殖率が高められることが明らかとなった。そこで、‘沖農P17’においても液体培養を行うことで、より効率的な増殖を行える可能性がある。
本調査では、‘沖農P17’の大量増殖に適した培養条件を確立するため、最適な培地条件の検討を行った。(本調査は沖縄県より受託した平成27年度熱帯果樹優良種苗普及システム構築事業の一環として実施した。)
2)材料と方法
(1)材料
パインアップル‘沖農P17’の冠芽、吸芽等
(沖縄県農業研究センター名護支所より提供)
(2)滅菌処理
葉を茎の付け根から取り除き、茎の褐変した部位をメスで削ぎ落とすことで粗調整を行った。腋芽を露出させた茎をプラスチック製の容器に入れ、食器用洗剤を少量加えた有効塩素濃度1%の次亜塩素酸ナトリウム水溶液で攪拌しながら20分間滅菌処理を行った。処理後はクリーンベンチ内にて茎を滅菌水で3回洗浄して次亜塩素酸ナトリウム水溶液を取り除いた。茎から腋芽と茎頂部をメスで切り出し、これを再度1%有効塩素の次亜塩素酸ナトリウム水溶液で軽くゆすぎ、滅菌処理を行った。滅菌処理後は再度滅菌水で1回洗浄した。
(3)培養
実験に用いる培地は1/2MS(ビタミン類は等倍)にスクロース20g/Lを添加、pH5.8に調整したものを基本とし、BA 1mg/Lもしくは2mg/L添加した試験区、固化剤であるアガロースを7g/L添加もしくは添加無しの試験区を設けた(表-1)。なお、アガロースを添加していない液体培地を用いた試験区では、50rpmで旋回培養を行った。培養環境は25℃、16時間明期、光強度は5000Luxとした。腋芽や茎頂部からシュートが発生したものは1か月に1回の周期で移植を行った。培養状況の記録はシュートの発生が見られた芽のうち、各試験区15個ずつについて行った。
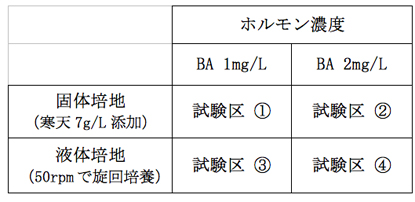
表−1培養に用いた培地の組み合わせ
3)結果
(1)滅菌処理
10/22~10/29に無菌化を行った。冠芽及び吸芽29個から364個の腋芽及び茎頂部を摘出した。そのうち、47個(13%)がコンタミにより枯死し、さらに240個(66%)が培養する過程で白化枯死した。残り78個(21%)の腋芽及び茎頂部についてシュートの発生が見られた。
(2)培養
培養を開始して早いものでは5日程度で無菌化した腋芽が白色から緑色になり、芽の肥大が始まった。その後、約60日目には液体培地で培養している一部のから多芽体の形成が確認された。一方、固体培地で培養している芽から多芽体の形成が確認されたのはそれより遅い約90日目であった(写真-1)。液体培地で培養をしている試験区では固体培地に比べ増殖率が極めて高く、培養開始130日後には多くの多芽体が10芽以上から構成される大きなコロニーとなった(表-2)。

写真-1 培養開始約0、30、60、90、120日後の多芽体の状況
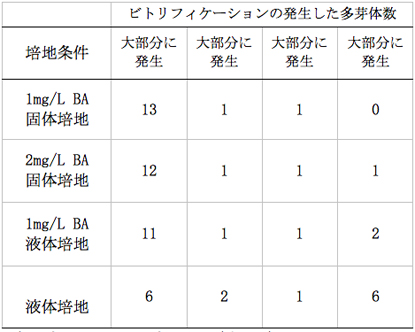
表−2培養開始約130日後の多芽体の数
液体培地では固体培地と比較してビトリフィケーション(組織が水浸状になる現象。この症状が発生した芽は正常な成長をしなくなる)が多く発生した(表-3、写真-2)。特に2mg/L BAを添加した試験区において顕著に発生した。部分的にビトリフィケーションが発生した多芽体では発生部の生育と増殖が遅いため、培養を継続するうちに生育旺盛な正常な部分と置き換わる傾向があったが、全体的に発生した多芽体では正常な多芽体が発生することが殆どなかった。また、初期の段階から正常な多芽体を形成していたものは、途中からビトリフィケーションが発生しこれに置き換わることはなかった。
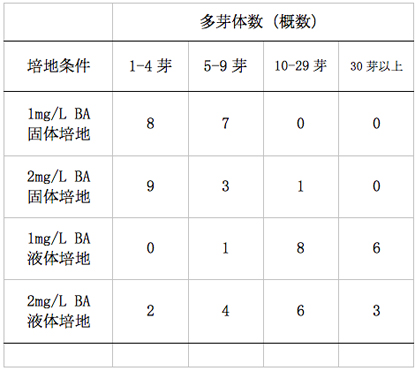
表−3培養開始約130日後のビトリフィケーションの発生状況

A

B

C

D
写真-2 ビトリフィケーションの様子
A. 正常な多芽体 B. 一部分に発生した多芽体(矢印はビトリフィケーションが発生した部分を指す)
C. 大部分に発生した多芽体(矢印は正常なシュートを指す) D.全体に発生した多芽体
2. 固体培地培養由来の多芽体を用いた液体培地切り替え後の増殖率の変化
1)緒言
パインアップル‘沖農P17’の大量増殖に伴う培地条件の検討を行った結果、液体培地を用いて培養することで多芽体の増殖率が飛躍的に向上することが明らかとなった。しかし、液体培地を用いた試験区ではビトリフィケーションの発生率を高める結果となり、培養初期の正常な苗の獲得数は固体培地の方が多かった。液体培養の初期の段階から正常な多芽体を形成していたものは、途中からビトリフィケーションが発生しこれに置き換わることはなかったため、固体培地で誘導された正常な多芽体を途中から液体培地に移すことで、ビトリフィケーションを起こさず効率的な増殖を図ることができると考えられる。本調査では固体培養由来の多芽体を液体培地に切り替えて培養することでビトリフィケーションを発生させずに増殖率を高めることができるか確認を行った。(本調査は沖縄県より受託した平成27年度熱帯果樹優良種苗普及システム構築事業の一環として実施した。)
2)材料と方法
(1)材料
パインアップル‘ゴールドバレル’の多芽体
(腋芽を1mg/L BAを含む固体培地にて約400日間培養したもの。1つの塊当たり10本前後の芽を有する塊)
(2)培養
パインアップル‘ゴールドバレル’の多芽体を、1mg/L BA、スクロース20g/Lを添加し、pH5.8に調整した1/2MS(ビタミン類は等倍)固体培地(アガロース7g/L)もしくは液体培地に各5個ずつ置床し、90日間増殖培養を行った。その後、ホルモンを除いた上記組成の固体培地に移植し、再生した植物体の数を調査した。培養環境と移植頻度は先の‘沖農P17’の試験と同様とした。
3)結果
増殖培養開始30日後には目視でわかるほど液体培地と固体培地で多芽体の芽数に大きな差が生じた。90日間増殖培養した多芽体から植物体を再生させた結果、液体培地で増殖させた試験区の方が約2.7倍多くの株が得られた。また、培養期間中にビトリフィケーションの発生は見られなかった。
3.考察
調査の結果、パインアップル‘沖農P17’を液体培地にて培養を行うことで多芽体の増殖率が飛躍的に向上することが明らかとなった。これにより‘沖農P17’をより迅速に普及することができると期待される。
しかし、培養初期より液体培地を用いた試験区ではビトリフィケーションの発生率を高める結果となった。固体培地培養由来の多芽体を液体培地に切り替えで培養する試験では、ビトリフィケーションの発生なく、固体培地よりも効率よく増殖に成功した。よって、培養の初期段階に固体培地を利用して培養を行い、ビトリフィケーションが発生していない正常な多芽体を得たのち、液体培養に切り替えることでさらに効率的な増殖が図れると考えられる。
メリクロン増殖を行う上で問題となる培養変異は、一般的に植物ホルモンを多量に用いることにより起きるとされる。本実験では高濃度の植物ホルモンに頼らず、培地を液体化させるだけで増殖効率を上げているため、培養変異のリスクは上がらないと想定される。しかし、パインアップルは液体培地で培養すると培養変異が起きやすくなるとの見解もあり、実用化に向けては変異性の調査が不可欠である。今回の試験で増殖した苗は順化を行い、遺伝的解析や形態観察を行い変異が生じていないか調査を行う必要がある。
*1植物研究室
Copyright (c) 2015 Okinawa Churashima Foundation. All right reserved.

